タンパク質は体の中で様々な役割を果たしています。例えば化学反応を触媒する酵素や筋肉の構成要素、抗体もタンパク分子です。こういったタンパク質の最小構成単位がアミノ酸です。
20種類の標準アミノ酸と呼ばれるものが直鎖状につながって折りたたまれて、いくつか集合することでタンパク質が出来上がります。今回はアミノ酸の構造と性質を紹介します。
目次
標準アミノ酸
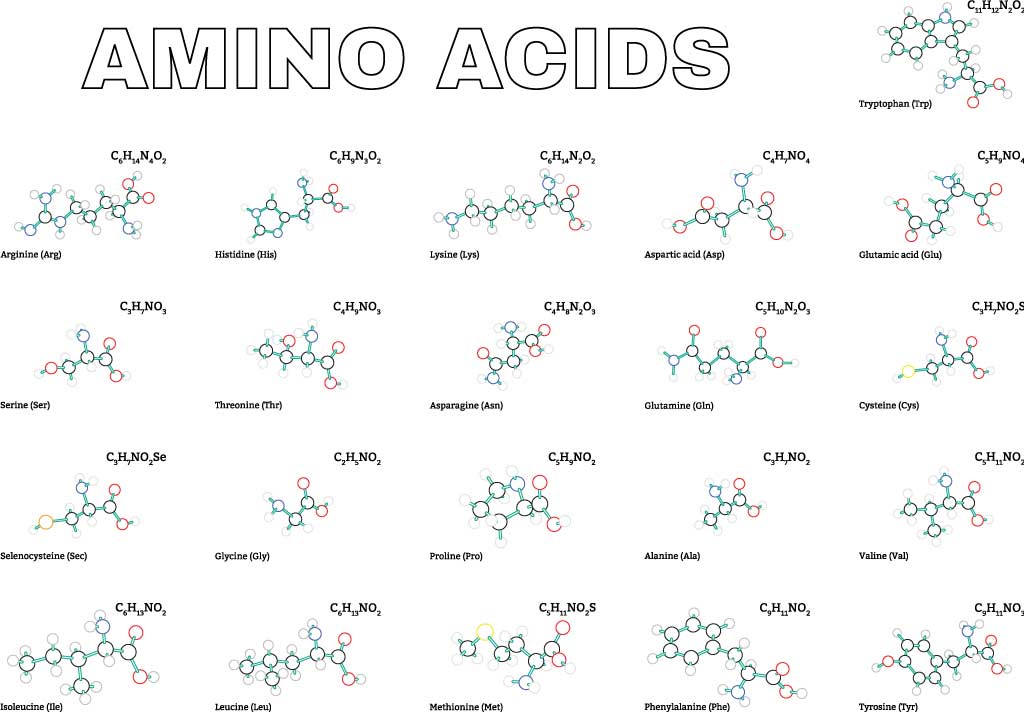
まず、全てのタンパク質は標準アミノ酸と呼ばれるアミノ酸からできています。以下にその標準アミノ酸を示します。それぞれアミノ酸の右側に書いたのは上から名称、3文字表記、1文字表記です。側鎖は青枠で囲いました。



α-アミノ酸
プロリンを除く上図のアミノ酸群はカルボキシ基に結合するα炭素に第1級アミノ基が結合したもので、α-アミノ酸と呼ばれます。プロリンはアミノ基に炭素が2つ結合した第2級アミノ基をもつので本当はイミノ酸です。
ただし、mRNAのコドンにはプロリンを指定するものもあるため広い意味で標準アミノ酸としてカウントしています。

溶液中での振る舞い|酸塩基解離
アミノ酸を溶液に加えたときのpHと解離型の関係を、もっとも単純なグリシンを例にして下の図に表しました。

グリシンのカルボキシ基のpK値が2.35、アミノ基のpK値が9.78です。どのpHにおいてもグリシンがイオン化しているのがわかります。アミノ酸は水溶液中では常にイオンの状態でいます。アミノ酸は酸でもあり塩基でもある両性電解質です。
グリシンに限らずカルボキシ基のpKは約2.2、アミノ基のpKは約9.4です。生理的条件下でのアミノ酸は、アミノ基とカルボキシ基がともにイオン化していることがわかります。この状態を両性イオンや双極イオンと呼びます。
アミノ酸からタンパク質へ|ペプチド結合と1次構造
α-アミノ酸は脱水縮合によりペプチド結合を形成することができます。このようにα-アミノ酸がペプチド結合によってつながったものをペプチド結合と呼びます。
2個縮合したものはジペプチド、3個縮合するとトリペプチド、だいたい10個以内であればオリゴペプチド、たくさん縮合すればポリペプチドと呼んだりします。
ペプチドは線状につながるので途中で分岐することはありません。さらに、ペプチドにおける各アミノ酸のことを特にアミノ酸残基といいます。

タンパクは、このように線状につながったペプチドが1本以上組み合わさって出来たものです。アミノ酸配列を指定するDNAも線状構造を取っているので1対1対応させることができます。
タンパクを構成する標準アミノ酸は高々20種類ですが、2個つながっただけても配列の場合の数は202=400通り、10個つながれば2010=1.024×1013通りにもなるためタンパクの多様性は実に高いと言えます。
側鎖の性質
タンパク質が合成される過程で、アミノ酸がつながってできたペプチドは正しく折りたたまれなければなりません。
正しく折りたたまれないとペプチド同士が凝集して結晶化し、体内で毒になります。折りたたみの過程については今回触れませんが、その特徴として親水性の側鎖が水和できるように外側を向き、疎水性の側鎖が水に触れないよう内側を向くように折りたたまれます。
こういった意味で標準アミノ酸は、
- 側鎖が非極性
- 側鎖が極性をもつが無電荷
- 側鎖が極性をもち電荷ももつ
の3種類に分類することができます。
非極性側鎖
グリシンやアラニンといった側鎖が非極性のアミノ酸は、タンパク質合成における折りたたみの過程で内側を向くように配置されます。
チロシンは非極性側鎖ではありませんが、それも含めてフェニルアラニンとトリプトファンは芳香族であることから紫外線を吸収します。このことから、タンパク質を分光学的に解析することも可能です。
極性無電荷側鎖
側鎖が極性無電荷のアミノ酸はヒドロキシ基やチオール基、酸アミドを含みます。システインは側鎖のチオール基が酸化されると、もう1つのシステイン側鎖との間でジスルフィド結合を形成します。ジスルフィド結合によって1本のポリペプチド鎖が一部環状になったり、別のポリペプチド鎖と架橋(橋渡し)することができます。
タンパク質を分解してアミノ酸の配列を測定する際に、グルタミンとアスパラギンは酸性または塩基性条件で容易に加水分解されて、それぞれグルタミン酸とアスパラギン酸になってしまうため注意がひつ量です。
したがって、グルタミン(Gln)とグルタミン酸(Glu)の3文字表記をGlx、アスパラギン(Asn)とアスパラギン酸(Asp)の3文字表記をAsxで表したりします。
非標準アミノ酸
タンパクの標準アミノ酸残基の中には修飾されるものも存在します。生理的に重要なアミノ酸は何も標準アミノ酸だけではありません。グルタミン酸から合成されるγ-アミノ酪酸(GABA)は抑制性の神経伝達物質として作用します。